I VACCINI SARS2-COV PRONTI AL VIA
Ormai stiamo entrando in una fase dove parlare di vaccinazione di covid non é più solo una speranza lontana. In queste prossime settimane le informazioni relative ai nuovi vaccini ed alle problematiche correlate alla somministrazione di ognuno di essi occuperà a cadenza regolare giornali e media. Dobbiamo abituarci. Molti vaccini sono già in fase avanzata di sperimentazione, quindi nella fase 3, altri sono in fase più sperimentale.
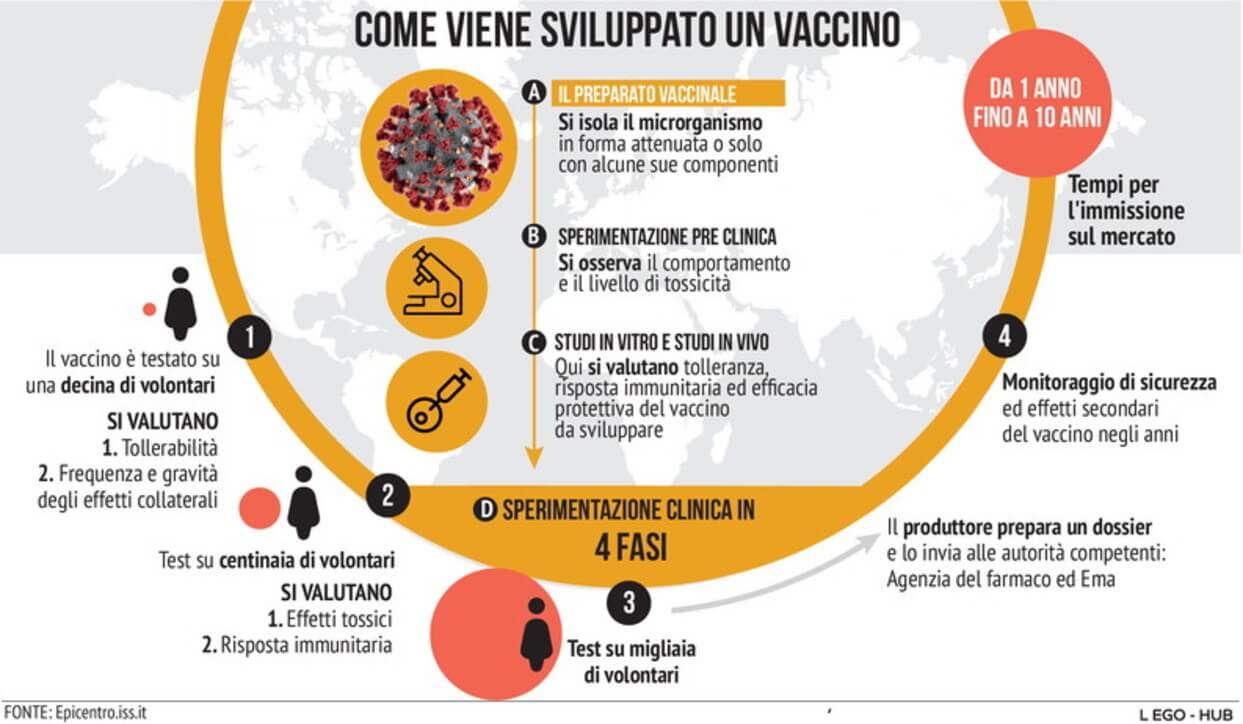
Ecco i vaccini ormai pronti al via:
Il virus inattivato scelto da Sinovac (Cina), la via dell’RNA da Pfizer e Moderna (Usa), gli adenovirus che trasportano antigeni da AstraZeneca (Uk), Sputnik (Russia), Cansino (Cina), Johnson & Johnson (Usa), la proteina Spike da Novavax (Usa) e Sanofi (Francia). Speriamo di essere giunti ad un nuovo inizio per tutti noi. Intanto é già pronto un piano vaccini.
Tra le priorità del governo c’è quella di “somministrare il vaccino anti-Covid direttamente nelle strutture ospedaliere e, tramite unità mobili, nei presidi residenziali per anziani”. E’ quanto si legge nel Piano per i vaccini contro il coronavirus che il commissario per l’emergenza, Domenico Arcuri, ha inviato ai presidenti delle Regioni e ai ministri della Salute e degli Affari Regionali. La somministrazione su larga scala avverrà attraverso i drive-in.
Il PUNTO SUI VACCINI
Facciamo il punto sui vaccini grazie a questo articolo apparso su WIRED. IT.
Ormai è evidente a tutti: siamo entrati nello sprint finale della corsa al vaccino contro il coronavirus Sars-Cov-2. Nel giro di una settimana sono infatti state annunciate sia la formulazione sviluppata da Pfizer-Biontech sia quella targata Moderna, senza contare il terzo incomodo rappresentato dal vaccino russo Sputnik V.
Nel rincorrersi delle notizie, che provoca non pochi su e giù alle quotazioni dei titoli in borsa, è facile dar ascolto più a slogan e ad altisonanti annunci mediatici che alle questioni davvero rilevanti per il futuro della pandemia. Ecco allora alcuni punti di attenzione, per evidenziare analogie e differenze tra quelli che al momento sembrano i primi vaccini pronti ad arrivare sul mercato: Bnt162b (Pfizer-Biontech) e mRna1273 (Moderna).
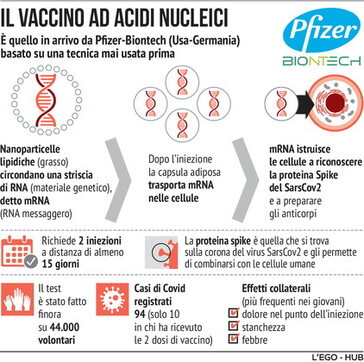
Il meccanismo di funzionamento a mRna
Le due soluzioni vaccinali funzionano di fatto allo stesso modo. Il vaccino contiene le informazioni genetiche (sotto forma di rna messaggero) affinché i ribosomi delle nostre cellule possano produrre la proteina spike del coronavirus Sars-Cov-2. Questa proteina – che coincide con quella attraverso cui il virus si aggancia alle cellule bersaglio – una volta in circolo stimola una risposta immunitaria, portando il corpo a generare anticorpi neutralizzanti e cellule T, proprio come se fossimo stati attaccati dal vero virus.
Questo meccanismo è diverso rispetto ai vaccini più tradizionali, in cui la proteina spike viene iniettata direttamente, ed è una grossa novità dal punto di vista dell’approccio all’immunizzazione che accomuna le due formulazioni. Entrambe, peraltro, richiedono una doppia iniezione, a qualche settimana di distanza: 21 giorni per Pfizer e 28 per Moderna.

L’annuncio (solo) mediatico
Si tratta di un altro punto decisivo, valido per tutte e due. A oggi non abbiamo a disposizione alcuno studio scientifico sulla fase 3 (ossia quella finale) della sperimentazione, ma solo una comunicazione ai media basata “sull’analisi dei dati preliminari“. Anche se non c’è motivo di credere che le informazioni siano false, è importante distinguere la fase mediatica dell’annuncio da quella scientifica, che passa per il vaglio della comunità degli scienziati, per la peer review e per rigorose valutazioni sulla validità degli studi e dei risultati.
Si ritiene comunque probabile che i paper scientifici arrivino a breve, entro qualche settimana. E in questo contesto i pochi giorni di distanza tra i due annunci mediatici (fatti sempre di lunedì, peraltro) potrebbero non essere affatto indicativi di chi completerà l’iter per primo.
Quasi un 5% di scarto
Sembra quasi una gara al rialzo. La settimana scorsa Pfizer-Biontech aveva annunciato un’efficacia del proprio vaccino nel prevenire il Covid-19 poco superiore al 90%. Poi è arrivata la Russia sbandierando un 92%. E infine Moderna ha dichiarato un’efficacia del 94,5%.
Questi numeri meritano due considerazioni. Anzitutto, sono tutti molto più grandi di quanto si sperasse. Già un’efficacia al 50% sarebbe stata ritenuta un buon risultato, ed essere nell’ordine del 90%-95% significherebbe un traguardo eccezionale. Non è chiaro, però, quanto queste percentuali siano destinate a essere confermate, sporattutto se si guarda alla cifra delle unità. Trattandosi di numeri sperimentali ancora relativamente piccoli, in cui un solo caso di differenza sposterebbe i valori in modo significativo, non è difficile credere che la valutazione di efficacia possa variare come minimo di qualche percento, e inoltre bisognerà valutare eventuali oscillazioni in funzione della fascia d’età. Dunque la differenza di efficacia del 5% per ora non è significativa né indicativa.
94/164 e 95/151
Affinché la sperimentazione di fase 3 possa dirsi conclusa, occorre raggiungere una prestabilita soglia nel numero di persone che hanno contratto il Covid-19 tra i partecipanti allo studio (nel gruppo dei vaccinati o in quello di controllo, a cui è stato somministrato un placebo). Per il vaccino Pfizer-Biontech si è parlato di 94 casi su un totale di 164 da raggiungere, mentre Moderna per la propria sperimentazione ne ha annunciati 95 (di cui 90 nel gruppo di controllo), ma con una soglia fissata a 151. La differenza nel traguardo dipende dal numero di partecipanti coinvolti, che sono 43mila nel primo studio e 30mila nel secondo.
In entrambi i casi le proiezioni lasciano immaginare che serva ancora qualche settimana per arrivare alla conclusione dell’indagine, ma è impossibile al momento essere più precisi. Curiosamente, peraltro, le due sperimentazioni sono iniziate nello stesso giorno, il 27 luglio scorso.
Temperatura e tempi di conservazione
Come abbiamo già raccontato in altre occasioni, le modalità di conservazione del vaccino sono decisive per la gestione logistica delle dosi, e possono fare la differenza tra l’una e l’altra formulazione. Da quanto sappiamo al momento, il vaccino Pfizer-Biontech ha bisogno di temperature basse e dell’ordine dei -75°C (o comunque tra i -70°C e i -80°C). Solo negli ultimi giorni prima dell’iniezione può essere portato in un normale frigorifero: a una temperatura di 4°C, infatti, può resistere per 5 giorni.
La formulazione di Moderna, invece, può essere conservata ad appena -20°C (dunque parrebbe avere un importante vantaggio competitivo) per un massimo di 6 mesi di stoccaggio. Poi deve restare conservata tra i 2°C e gli 8°C fino a un massimo di 30 giorni (non più un massimo di 7 giorni, come si stimava), e a temperatura ambiente per una ulteriore mezza giornata. Si tratta di informazioni non ancora definitive e certificate, ma la differenza tra i -75°C e i -20°C potrebbe rivelarsi un punto fondamentale.
Quando saranno disponibili?
Per il vaccino di Moderna, se tutto filerà liscio, si prevede che l’uscita dal territorio statunitense delle prime dosi non accadrà nel 2020, mentre nel Nord America già entro dicembre saranno sfornati i primi 20 milioni di dosi. Al momento non ci sono date certe, ma c’è la promessa di arrivare entro fine 2021 a produrre tra 500 milioni e 1 miliardo di dosi. Leggermente diversi, ma non così lontani, i numeri di Pfizer-Biontech: 1,3 miliardi di dosi prodotte entro il prossimo anno, ma già i primi 50 milioni entro questo dicembre.
In entrambi i casi, e come peraltro già sta accadendo anche per altri candidati, la sperimentazione procede di pari passo con la produzione, in modo da mettersi avanti con i lavori per il momento dell’eventuale (e sperata) approvazione.
Capacità eradicante e sicurezza a confronto
Su questi due aspetti c’è ancora molta incertezza per entrambe le formulazioni. Sulla sicurezza al momento non sono state segnalate particolari criticità, a parte qualche effetto collaterale come stanchezza, dolori, eritema nell’area dell’iniezione, mal di testa e altri sintomi minori.
Restano invece aperte due importanti partite, probabilmente decisive per il prosieguo dell’emergenza sanitaria. Non è ancora chiaro, infatti, se i vaccini proteggano solo dallo sviluppo della malattia Covid-19 vera e propria o se tengano del tutto il virus fuori dal corpo. In quest’ultimo caso potrebbero scongiurare la trasmissione del virus da persona a persona e quindi portare più facilmente verso la fine della pandemia, mentre nel caso si possa comunque essere contagiosi la situazione sarebbe meno rosea. L’altro elemento è relativo alla durata della protezione: fa molta differenza, infatti, se gli anticorpi sviluppati sono permanenti, di lunga durata oppure destinati a scomparire nel giro di pochi mesi.
Un po’ di geopolitica vaccinale
Interessante che le prime due grandi aziende ad annunciare il vaccino siano entrambe statunitensi. Moderna è in un certo senso la più statunitense di tutte, perché non collabora con un’azienda europea come fa Pfizer coordinandosi con Biontech. Ma soprattutto è interessante notare che non si tratta di successi da attribuire solo al settore privato. Entrambe le imprese, infatti, fanno parte dell’operazione nordamericana Warp Speed, e per esempio Moderna ha ricevuto 2,4 miliardi di finanziamento del governo statunitense e ha condiviso la fase di sviluppo con il National Institutes of Health. La sola Biontech, poi, ha ricevuto 375 milioni di euro di finanziamento dal ministero tedesco per la ricerca.
Dal punto di vista del prezzo finale, il vaccino Moderna dovrebbe costare intorno ai 25 euro, comprensivi di un margine di profitto. Pfizer-Biontech, invece, dovrebbe assestarsi appena sotto i 20 dollari, e al momento si parla di 19,50. Sia Pfizer sia Moderna chiederanno l’approvazione per l’uso in emergenza alla Food and Drug Administration statunitense, e si avvarranno della rolling review per accorciare i tempi dell’approvazione all’Agenzia europea del farmaco.
Ma dove sono tutti gli altri?
Al di là del già citato vaccino russo, per il quale le informazioni sono frammentarie e confuse, per gli altri vaccini in fase 3 di sperimentazione la situazione potrebbe non essere così diversa dai due più chiacchierati. In diversi casi, non ultimo quello AstraZeneca/Oxford, ci si aspetta la conclusione della sperimentazione nel giro di poche settimane, dunque l’effettiva autorizzazione e immissione in commercio potrebbe non essere molto distante nel tempo rispetto a Moderna e Pfizer-Biontech.
L’annuncio mediatico ha in qualche modo rotto gli indugi e creato grande scompiglio, ma sarebbe sbagliato cantare vittoria prima di essere davvero arrivati al traguardo. Le alternative in fase avanzata di studio, peraltro, includono tecniche vaccinali più tradizionali come quella proteica, che potrebbero rappresentare un’alternativa complementare rispetto alle soluzioni a mRna, e magari più semplice da gestire dal punto di vista logistico. Tra i vaccini potenzialmente in arrivo a breve ci sono per esempio quelli di AstraZeneca/Oxford, Sinovac, Janssen, Cansino, Butantan, Novavax ed Elea Phoenix. Ed è ancora presto però per tirare conclusioni, fino a che non si avranno sotto mano le pubblicazioni scientifiche con tutti i dettagli